Immunoterapia
L’immunoterapia è una strategia terapeutica per la cura delle malattie basata sull’attivazione di una risposta immunitaria. In anni recenti sono stati sviluppati alcuni approcci di immunoterapia molto efficaci nella cura dei tumori. L’immunoterapia finalizzata al trattamento delle neoplasie è detta immunoterapia oncologica.
- 1 Tipologie di immunoterapia
- 2 L’immunità contro i tumori
- 3 Le principali tipologie di immunoterapia oncologica
- 4 Fonti
Tipologie di immunoterapia
L’immunoterapia è un trattamento basato sull’impiego di sostanze che agiscono direttamente sul sistema immunitario per suscitare una risposta in grado di rappresentare una cura rispetto a diverse patologie. Lo scopo dell’immunoterapia può cambiare a seconda delle circostanze e può consistere nell’amplificare, sopprimere oppure indurre risposte immunitarie da parte dell’organismo.
Per approfondire: Quanto dura l’immunoterapia?
Partendo da questo aspetto possiamo distinguere due tipi di immunoterapia:
- Immunoterapia di soppressione, attuata quando l’obiettivo è suscitare una risposta depressiva da parte del sistema immunitario. Nel caso delle allergie, uno dei campi di applicazione di questa tipologia, il suo scopo è quello di “scoraggiare” l’ipersensibilità dell’organismo verso gli antigeni responsabili e limitare l’eccessiva reazione immunitaria solitamente scatenata nei soggetti quando entrano in contatto con essi. Il risultato è una desensibilizzazione dell’organismo nei confronti degli agenti scatenanti l’allergia e una minore predisposizione a soffrire di attacchi allergici. Questa logica viene applicata anche in pazienti che hanno subito un trapianto d’organo per limitare i fenomeni di rigetto, e per il trattamento delle malattie autoimmuni;
- Immunoterapia di attivazione, al contrario, si applica quando si vuole indurre una risposta o amplificarla da parte del sistema immunitario. L’immunoterapia antimicrobica e oncologica sono alcuni dei suoi campi di applicazione. Questa tipologia di immunoterapia viene utilizzata per il trattamento di cancri e tumori, immunodeficienza patologica (AIDS) o iatrogena (conseguenza di trattamenti come chemioterapia e/o radioterapia).
L’immunità contro i tumori
Il sistema immunitario è in grado di riconoscere ed eliminare le cellule tumorali. Sfortunatamente questa attività di controllo, detta immunosorveglianza, può fallire perché la cellula tumorale mette in atto delle strategie di autodifesa, come ad esempio limitando l’espressione di proteine che vengono riconosciute dalle cellule immunitarie, in un processo chiamato immunoevasione.
Per approfondire: Immunoterapia ed effetti collaterali: un approccio consapevole
Le cellule tumorali, inoltre, possono rilasciare microambiente tumorale citochine e altre molecole che hanno attività inibitoria sulle cellule del sistema immunitario, un processo detto di immunosoppressione. Oltre all’attività immunosoppressoria, tali molecole possono anche essere in grado di riprogrammare alcune cellule del sistema immunitario in modo tale che svolgano attività pro-tumorali anziché anti-tumorali.
Le principali tipologie di immunoterapia oncologica
Gli immunologi hanno iniziato a sperimentare approcci terapeutici contro il cancro basati sull’attivazione, la riattivazione o l’amplificazione delle risposte immunitarie diversi decenni fa, inizialmente senza grande successo.
L’immunoterapia si è dimostrata una strategia valida quando sono stati messi a punto gli inibitori dei checkpoint immunitari, e in tempi ancora più recenti con lo sviluppo delle terapie con le cellule CAR-T. Molte altre sperimentazioni sono ancora in corso, dato che il campo di ricerca è vasto e in rapido sviluppo.
Immunoterapia e inibitori dei checkpoint immunitari
Gli inibitori dei checkpoint immunitari (ICI) sono anticorpi monoclonali che legano i checkpoint espressi sui linfociti T o i ligandi espressi sulla cellula tumorale rimuovendo il segnale inibitorio e promuovendo quindi l’attività citotossica dei linfociti T contro le cellule maligne.
Gli ICI vengono somministrati per via endovenosa e sono impiegati nel trattamento dei tumori solidi in fase avanzata, tra cui:
- melanoma;
- carcinoma a cellule renali;
- carcinoma polmonare non a piccole cellule;
- tumore al colon;
- mesotelioma;
- carcinoma squamoso della testa e del collo;
- tumore al fegato;
- alcuni tumori della mammella;
- del linfoma di Hodgkin
Uno dei meccanismi attraverso cui le cellule tumorali sfuggono all’immunità è esprimendo sulla propria superficie proteine che interagiscono con altre proteine espresse sui linfociti T (delle cellule del sistema immunitario), dette proteine checkpoint. I checkpoint immunitari, come ad esempio i noti CTLA4 e PD-1, hanno la funzione di inibire la risposta immunitaria quando non è necessaria. Esprimendo i ligandi dei checkpoint (come ad esempio PD-L1, PD-L2), le cellule tumorali inattivano i linfociti T prima che questi possano riconoscerle ed eliminarle.
Gli ICI oggi utilizzati in clinica sono:
- agenti anti-CTLA-4 (Cytotoxic T-Lymphocyte Antigen 4) – ipilimumab;
- agenti anti-PD-1 (Programmed cell Death protein 1) – nivolumab, pembrolizumab;
- agenti anti-PD-L1 (Programmed cell Death Ligand 1) – atezolizumab, avelumab, durvalumab.
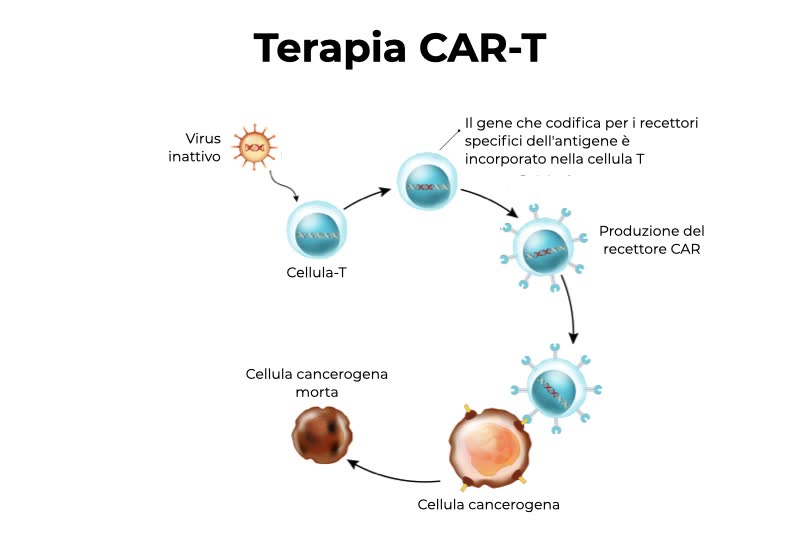
Immunoterapia e terapie CAR-T
Le terapie CAR-T (dall’inglese Chimeric Antigen Receptor T cell ovvero “cellule T esprimenti un Recettore Chimerico per l’Antigene”) sono terapie avanzate e costituiscono un esempio di medicina personalizzata, in quanto il trattamento viene generato in modo specifico per ogni singolo paziente: si prelevano le cellule da sangue, le si manipola in laboratorio e poi le si infonde nuovamente nel circolo sanguigno del paziente.
Il processo delle terapie CAR-T è laborioso e molto costoso. Ad oggi sono state approvate terapie CAR-T con recettori CAR che riconoscono l’antigene CD19 espresso dai linfociti B e quindi utilizzabili per curare alcuni tipi di leucemia e linfoma. Sono in studio altri trattamenti che utilizzano questa strategia per altri tumori ematologici e nei tumori solidi.
I linfociti T riconoscono gli antigeni, delle proteine presenti sulle cellule tumorali, tramite il recettore TCR (T Cell Receptor). Ogni linfocita T possiede un TCR specifico per un solo antigene. Pertanto, per riconoscere e distruggere una cellula tumorale, un linfocita T deve possedere un TCR per l’antigene espresso dalla cellula maligna.
Le terapie CAR-T si basano sull’ingegnerizzazione genetica dei linfociti T dei pazienti affinché esprimano un recettore CAR (Chimeric Antigen Receptor) che consente loro di riconoscere le cellule tumorali e di attivarsi contro il tumore. Il trattamento in questo caso non è costituito da una molecola chimica, ma da cellule vive, estratte dal paziente e reintrodotte dopo essere state modificate geneticamente.
Le terapie CAR-T attualmente approvate ed erogate dal Sistema Sanitario Nazionale italiano sono:
- tisagenlecleucel per il trattamento della leucemia linfoblastica acuta a cellule B e del linfoma diffuso a grandi cellule B;
- axicabtagene ciloleucel per il trattamento del linfoma diffuso a grandi cellule B e del linfoma primitivo del mediastino a grandi cellule B refrattari o recidivanti (che non rispondono alla terapia o che si ripresentano dopo altri trattamenti);
- brexucabtagene autoleucel per il trattamento del linfoma a cellule mantellari (MCL) refrattario o recidivante.
Per approfondire: immunoterapia: come si somministra?
Fonti
- Yang Y. Cancer immunotherapy: harnessing the immune system to battle cancer. J Clin Invest. 2015;125(9):3335-3337. doi:a10.1172/JCI83871
- Pan C, Liu H, et al. Next-generation immuno-oncology agents: current momentum shifts in cancer immunotherapy. J Hematol Oncol. 2020;13(1):29. doi:10.1186/s13045-020-00862-w
- Osservatorio Terapie Avanzate (la tabella con le terapie approvate e rimborsate dal Sistema Sanitario Nazionale è costantemente aggiornata)